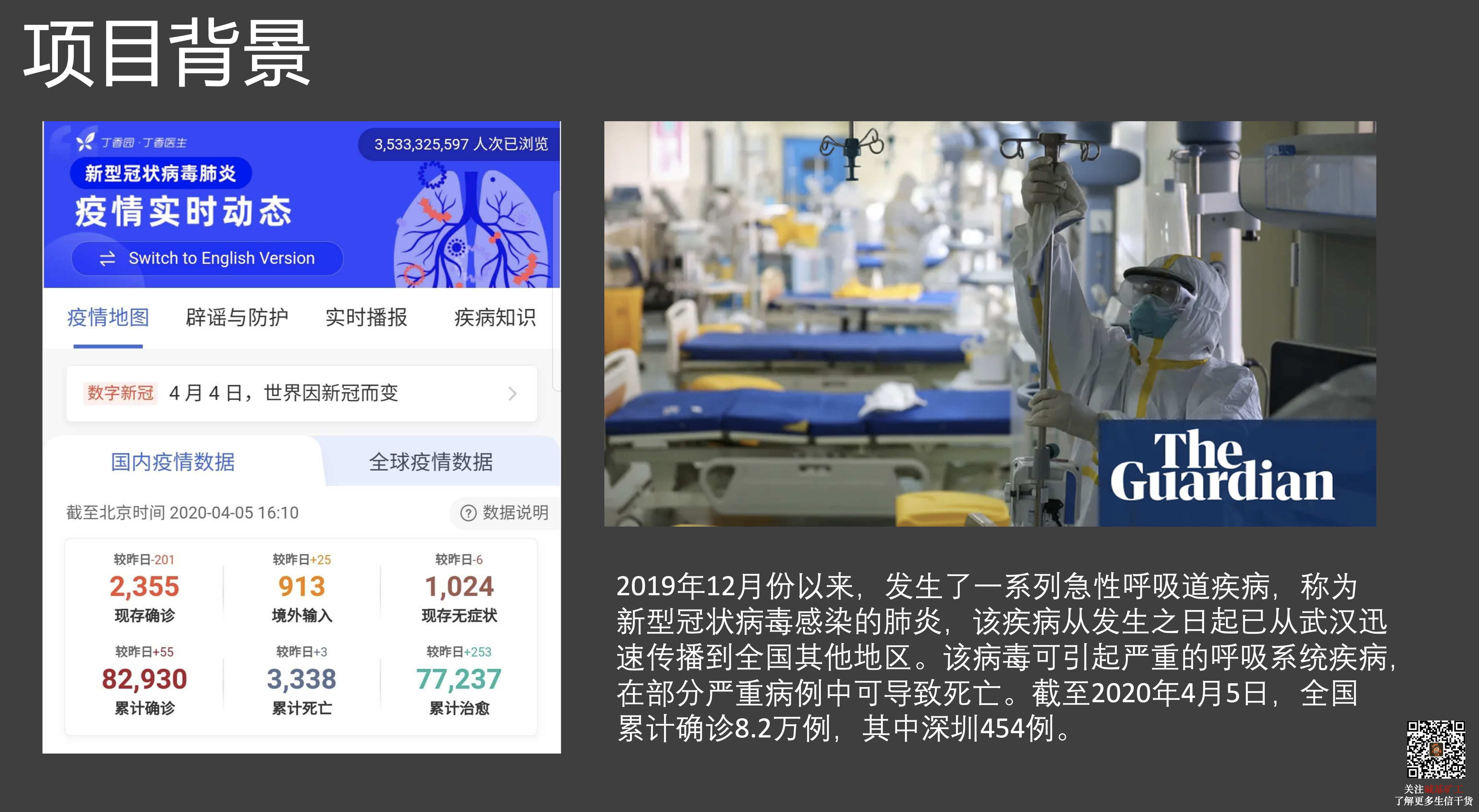
这篇文章源自于我在 2020 年的一次内部讲课 PPT,当时恰逢新冠大流行,我们也对此开展了一项 COVID-19 与宿主遗传特征方面的研究。当时这个课程属于科普性质的,没有涉及到太多研究上的内容,但后来成果发表了,所以在这篇文章中,我也将当时发表的结果在此处做展示。

什么是病毒
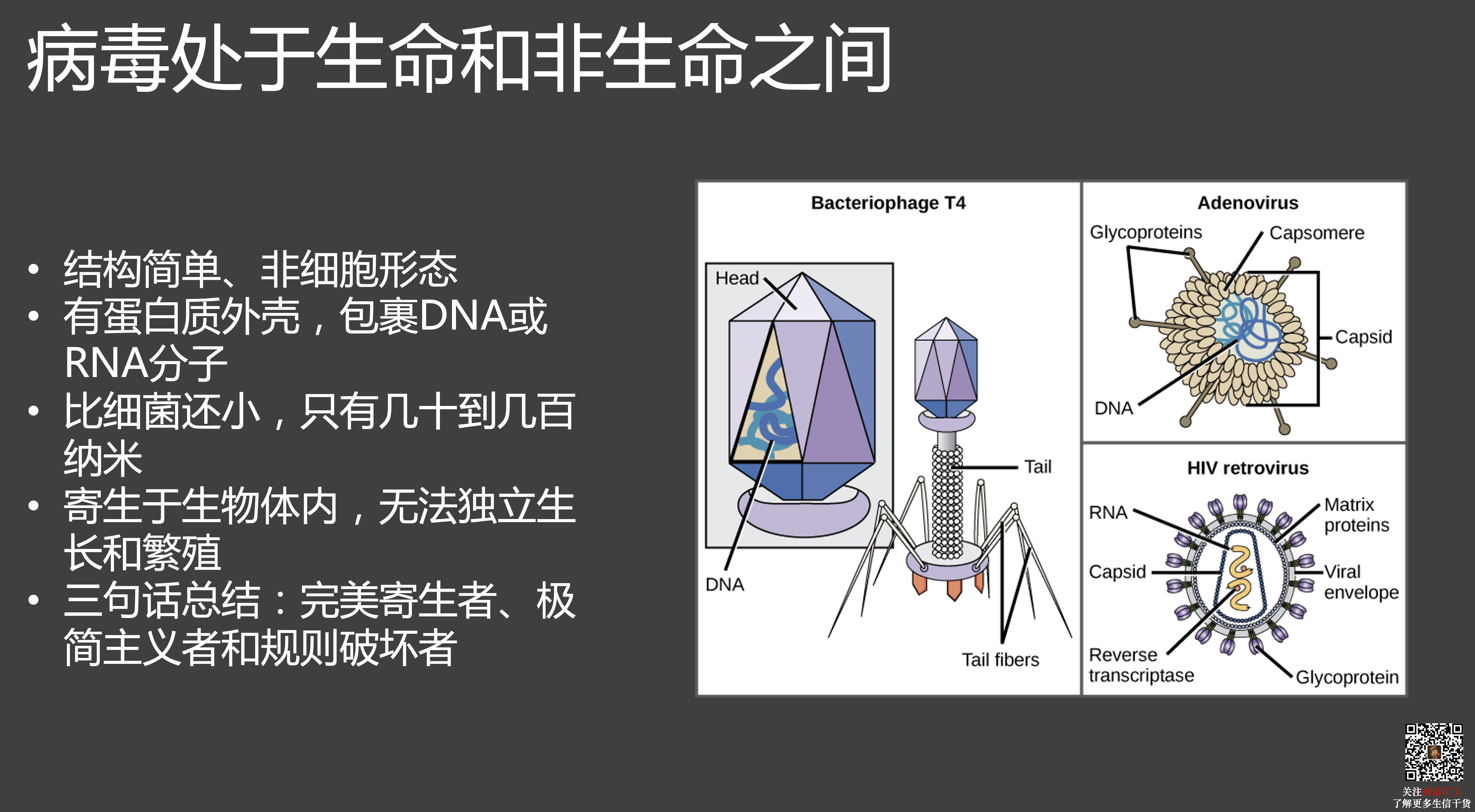

寄生虫只是把一小部分生物学功能转移给宿主,让宿主来帮忙完成罢了,它们自己还是完整的生命。
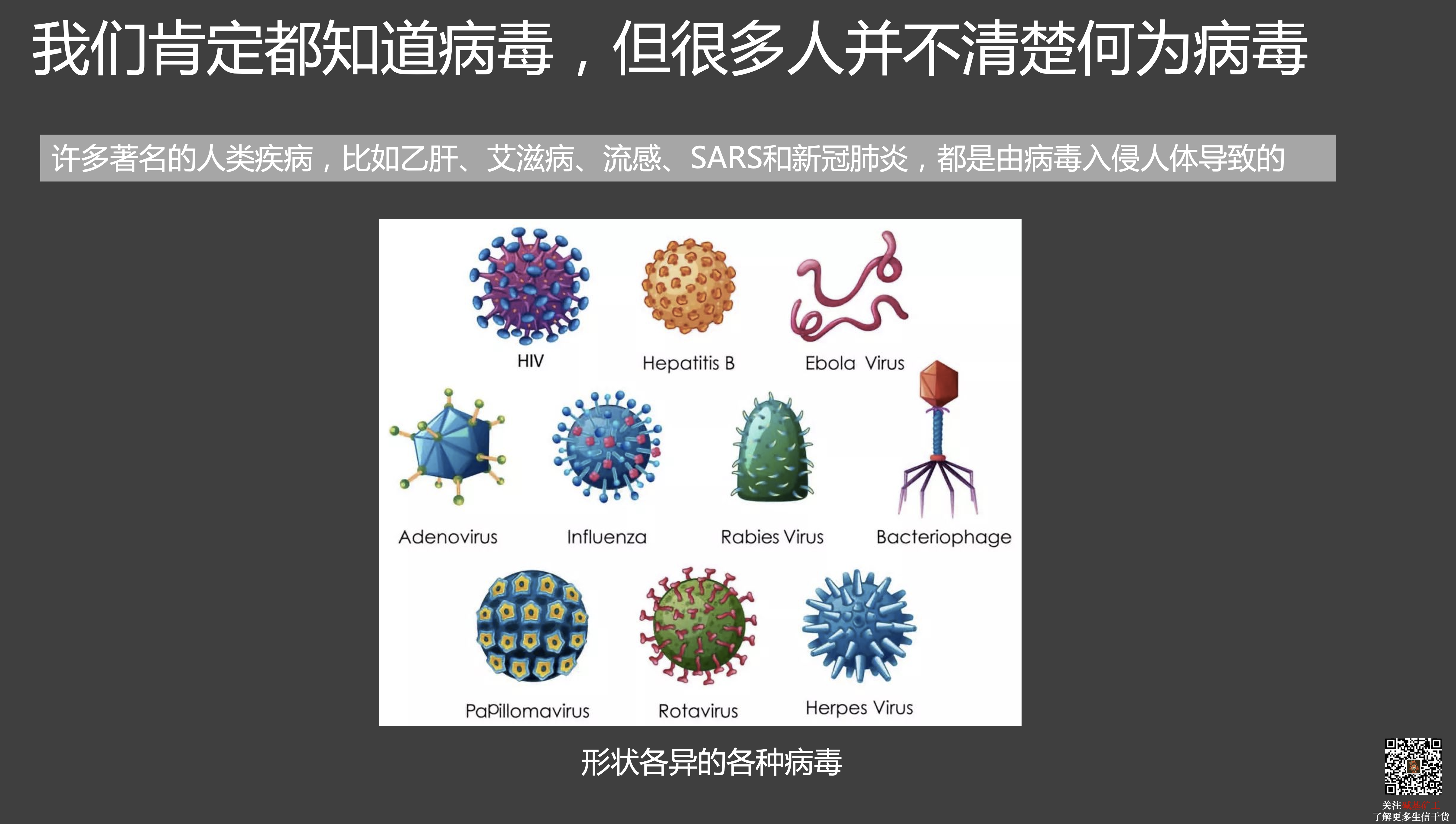
但是,病毒就完全不一样。在进入宿主之前,病毒根本就不是严格意义上的生命。它不需要能量,也不消耗能量,不呼吸,不动,更不会繁殖后代,完全处在静止和沉寂状态,和大自然里的一颗沙子、一堆尘土没有什么两样。也因为这个特点,只要条件合适,病毒就可以在大自然里稳定的存在超长时间。比如在2014年,法国科学家就曾经在西伯利亚地表之下30米深的永冻土中,找到了三万年前的活病毒。
而一旦进入宿主体内,或者更精确地说,是进入宿主细胞的内部以后,病毒会立刻展现出它全部的生命迹象。它们不需要吃东西,也不需要吸收能量,因为可以直接利用宿主细胞里唾手可得的能量;它们不需要自己繁殖后代,而会借助宿主细胞里现成的工具来帮助自己批量制造后代。
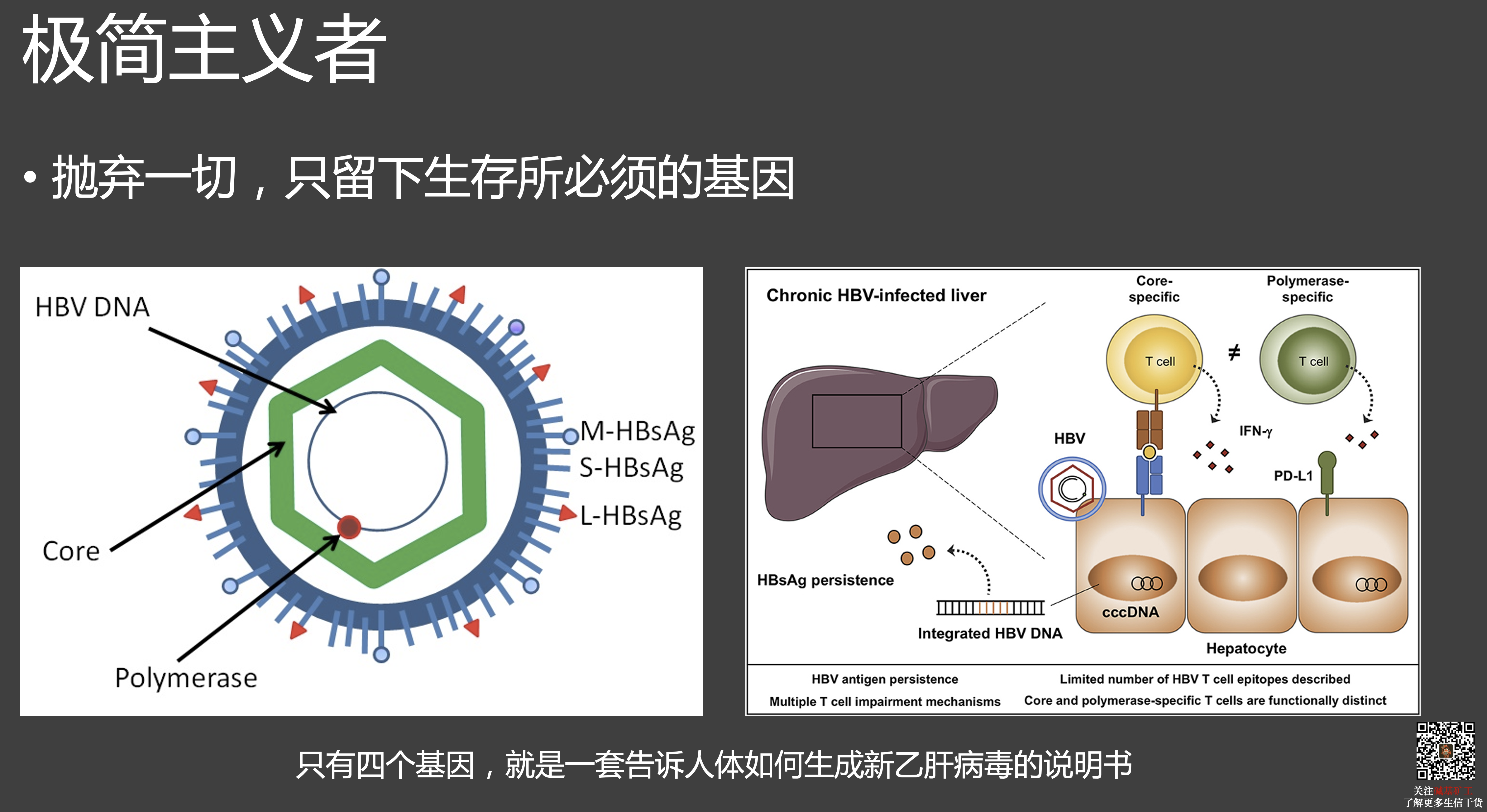
充分利用宿主的一切。

病毒从生存到繁殖有着很多我们对生命形态理解上的例外。比如,在宿主之外,它们不吸收和利用能量,甚至和砂石无异;而且不一定是通过 DNA 记录遗传信息,也不一定遵从中心法则。
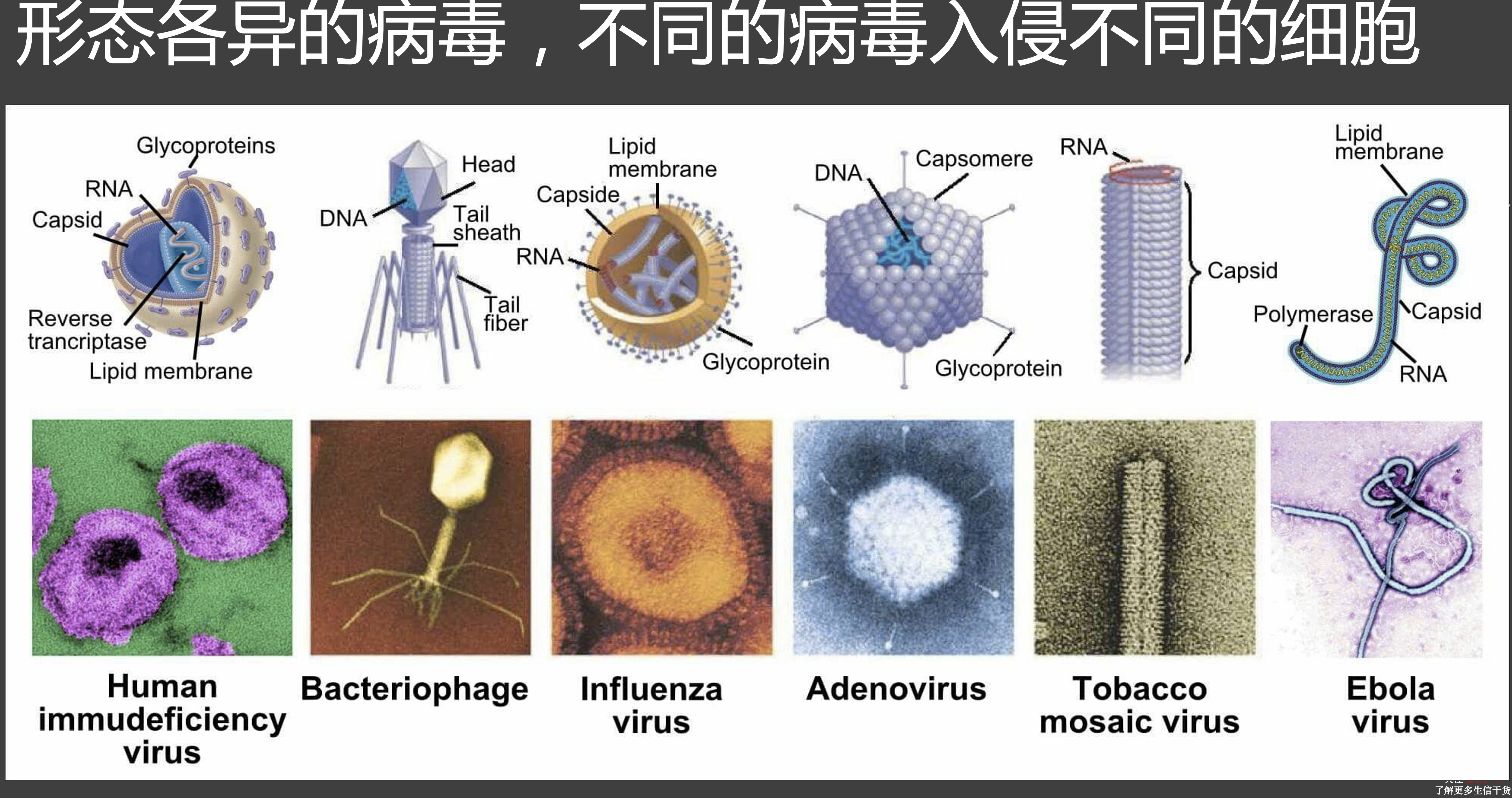
然而,病毒的起源还是一个谜.


总结
- 病毒本身不会导致疾病。只有病毒识别和入侵了宿主细胞,才会导致各种各样的疾病。
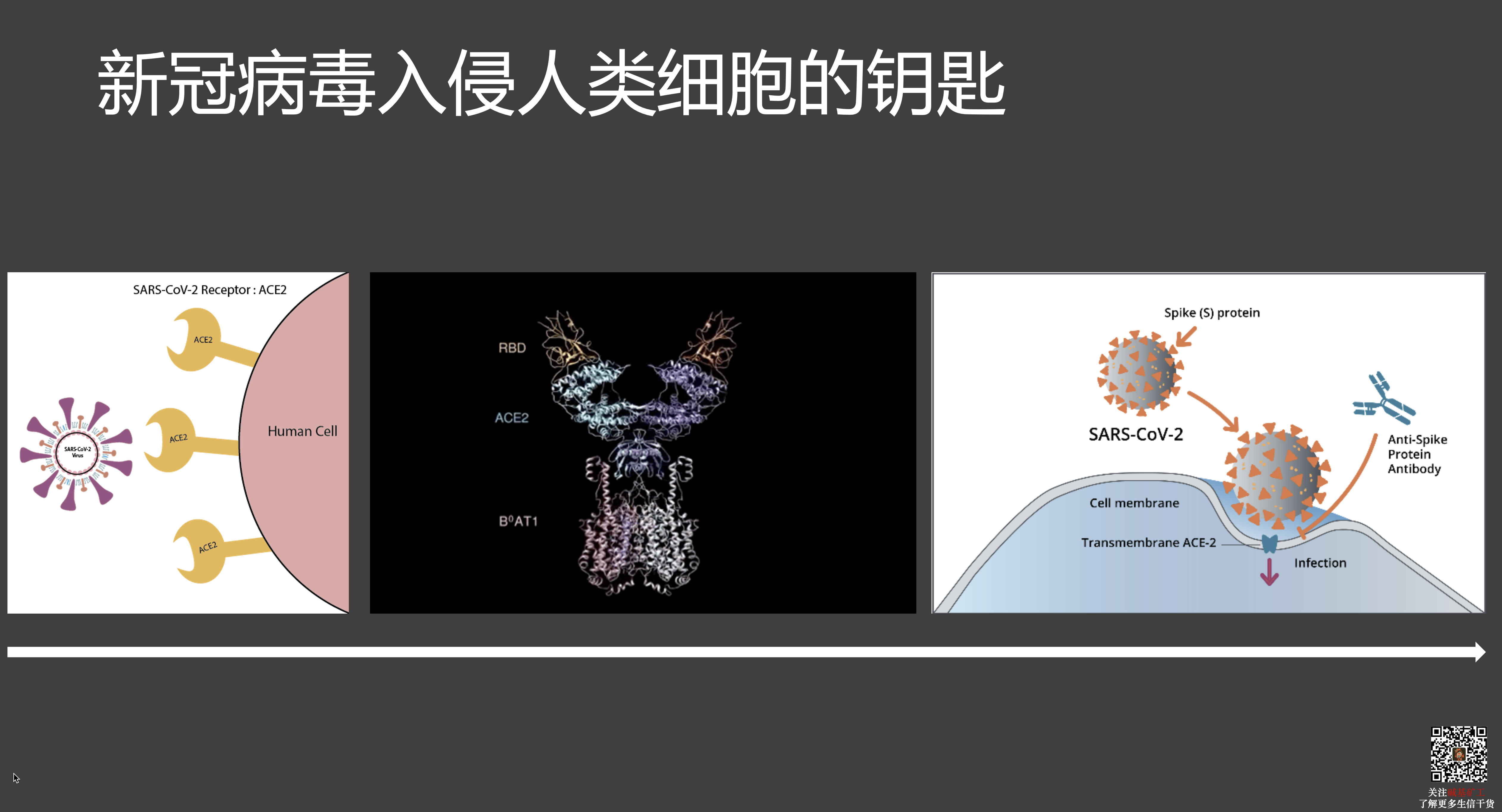
- 病毒依靠自己表面的蛋白质分子,去结合宿主细胞表面的特定蛋白质分子,完成识别和入侵宿主细胞的过程。这个过程完全是被动进行的,不需要病毒颗粒做任何事情。
- 在病毒入侵宿主细胞之后,可能会通过直接杀死宿主细胞导致疾病,也可能是宿主细胞过度的防御反应引发了疾病。
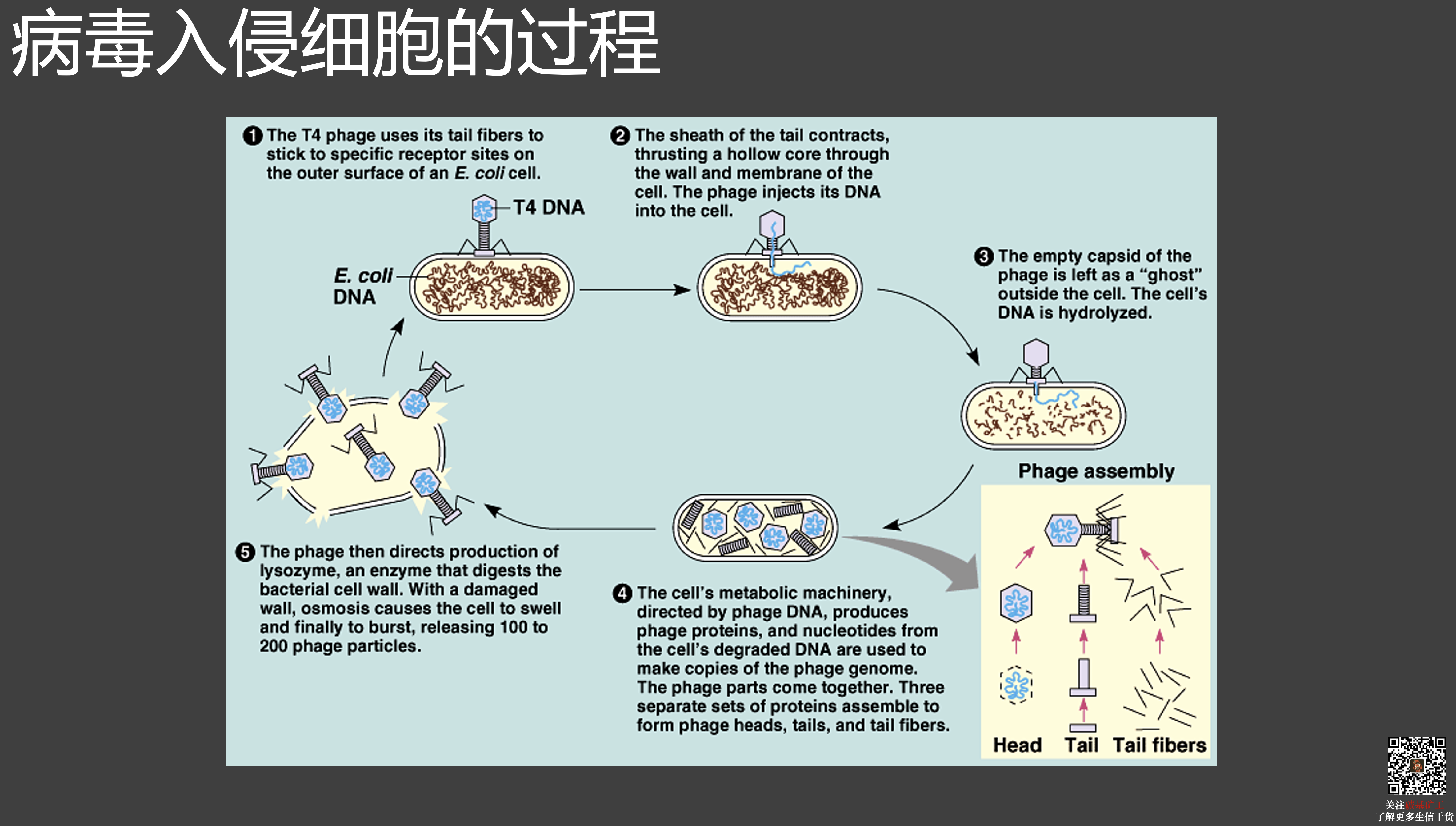

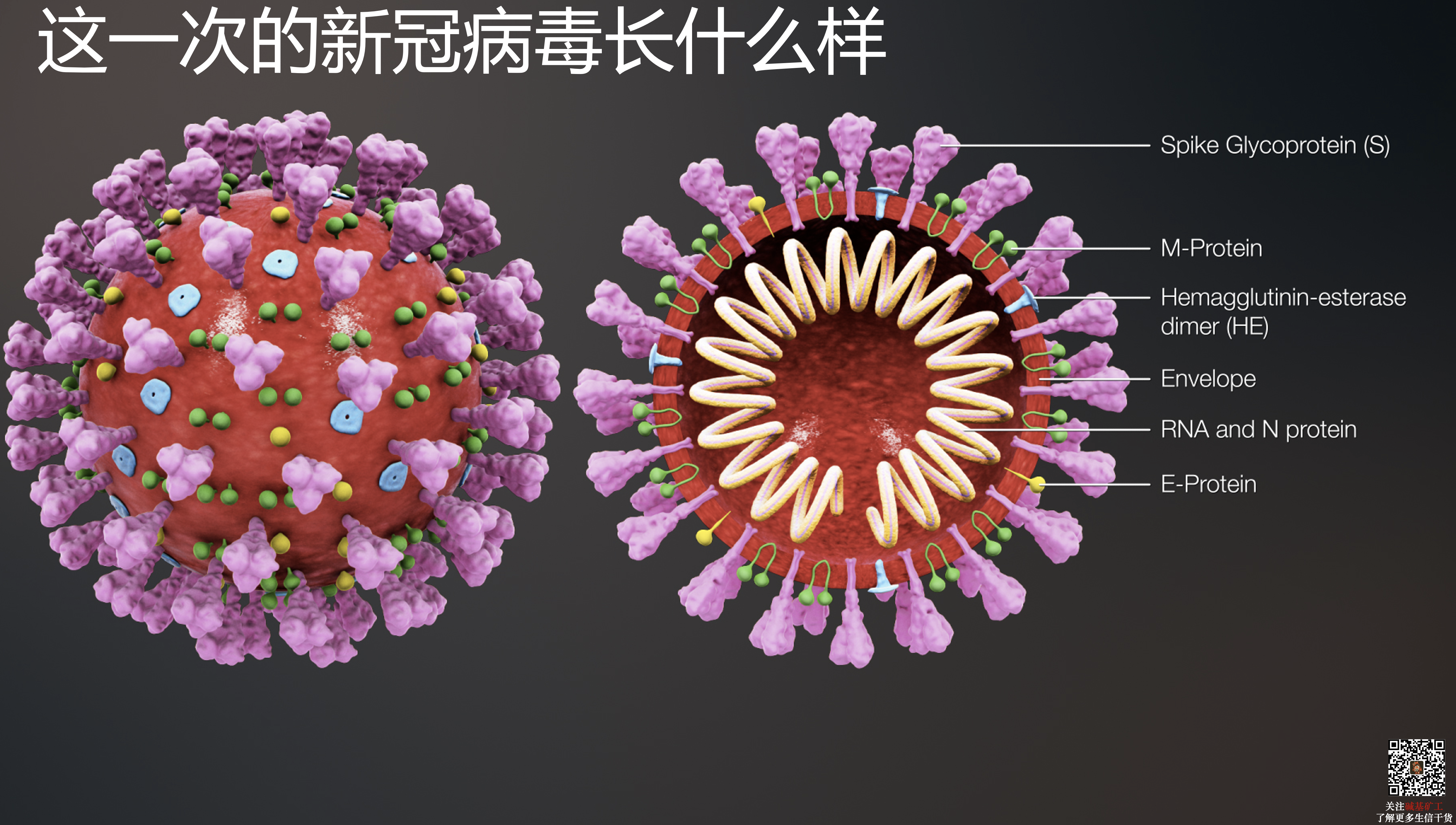

总结
在同一个生物个体内部,病毒可以快速地入侵、复制、离开,感染大量同类细胞。这是很多病毒导致疾病的根源。
借助飞沫传播、接触传播、粪口传播等等手段,病毒可以在不同的生物个体之间传播,甚至导致疾病的大流行。
在持续的传播和变异过程中,病毒得以逃脱宿主免疫系统的识别和追杀,也积累了跨越物种屏障,在另一个物种内部继续传播的能力。

“传染病的数学规律”,其实理解起来很简单。任何一种传染病想要持续地扩大感染规模,甚至是大流行,都必须能够从一个患者传染给超过一个健康人才行。如果一个患者在被感染期间,只能传染不到一个人,那每过一段时间患者的总数就会少一些,久而久之这种传染病自己就会慢慢消失。相反,一个患者能够传染的健康人越多,这个疾病的传播能力就越强,就越有可能成为一个大规模流行病。
如果用数学语言描述这个逻辑,就诞生了流行病学研究里很常用的“基本传染数”,也就是R0的概念。R0衡量的就是在没有采取任何措施的情况下,一个患者在感染期内能够传染的人数。
对于任何一个已经在流行的传染病来说,R0肯定都是大于1的。比如,根据历史经验我们知道,每年秋冬季的季节性流感的R0在1.2左右;1918年西班牙大流感的R0在2左右;2003年SARS的R0在2-5之间;而水痘和麻疹这两个疾病的传染能力极强,R0可能分别超过了5和10。至于2020年这场新冠疫情,它的原始毒株R0和SARS较为接近,而现在的奥密克戎(Omicron)已经远大于该值。
但是请注意,相比R0,也就是一种疾病在纯天然条件下的传播能力,实际传染数R这个指标就更有意义。因为它衡量的是我们人类能采取什么措施,限制疾病的流行。
所以,不管一个疾病的R0有多高,只要我们把实际传染数R降低到1之下,就可以有效的消除这种疾病。


##COVID-19 遗传易感性研究


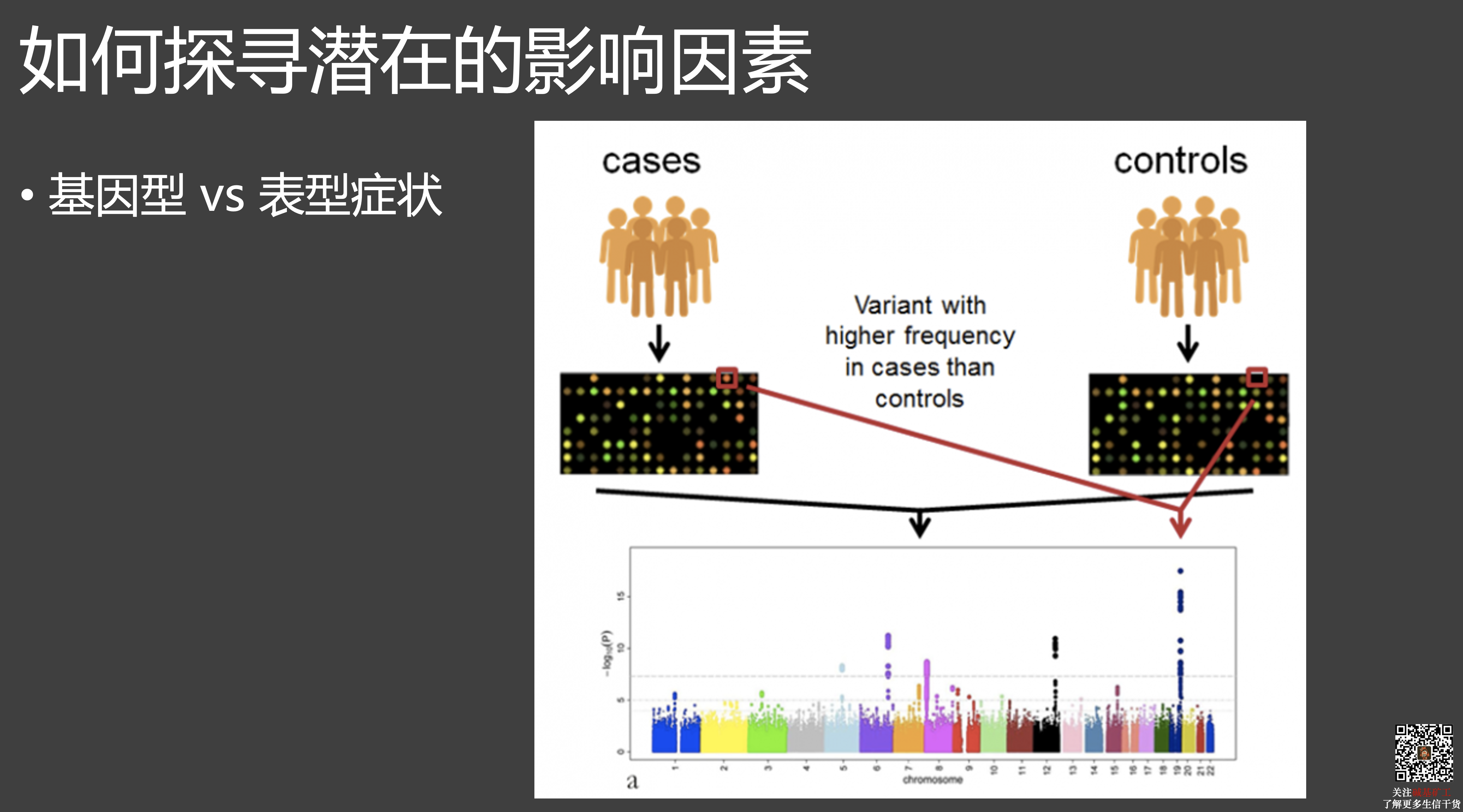
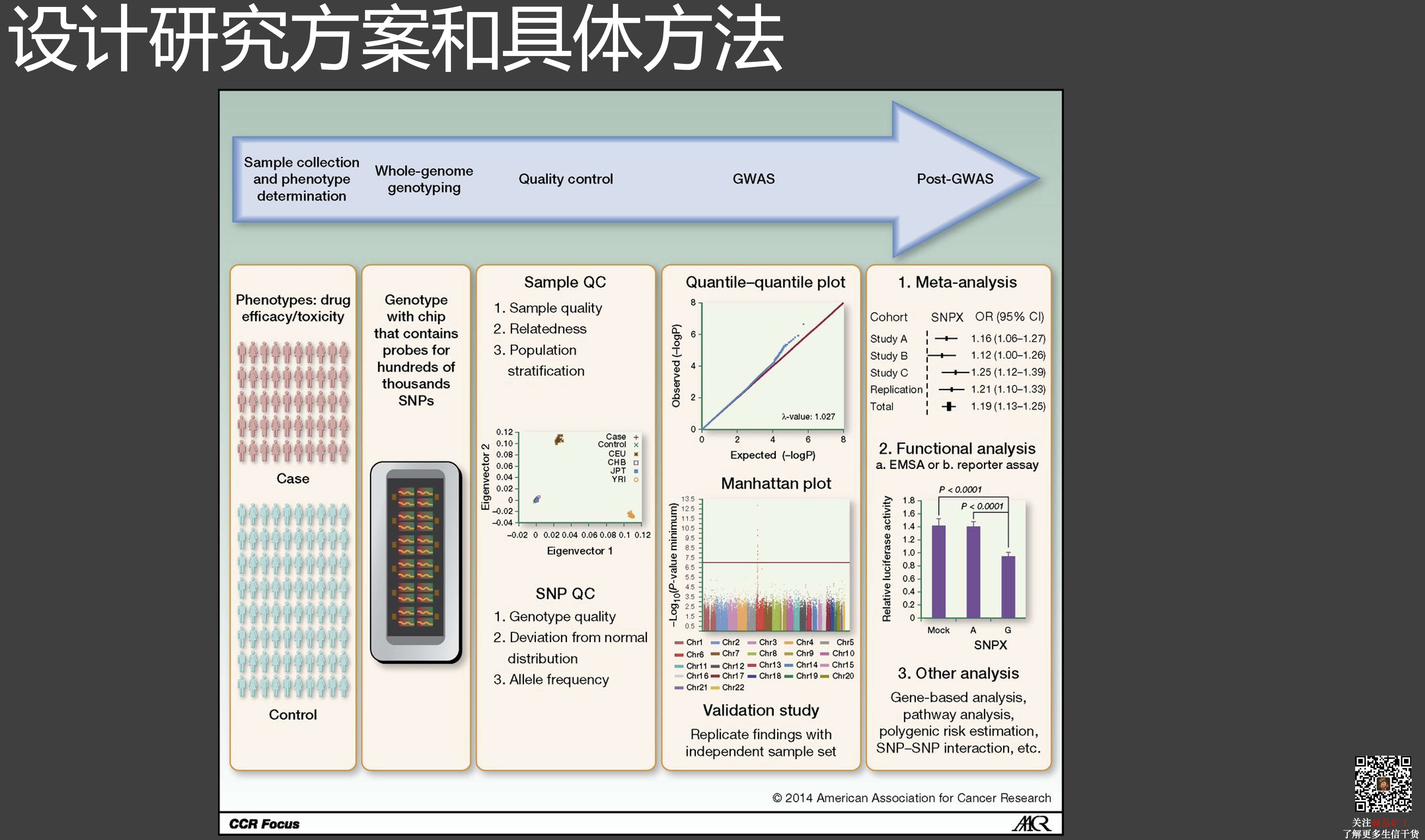
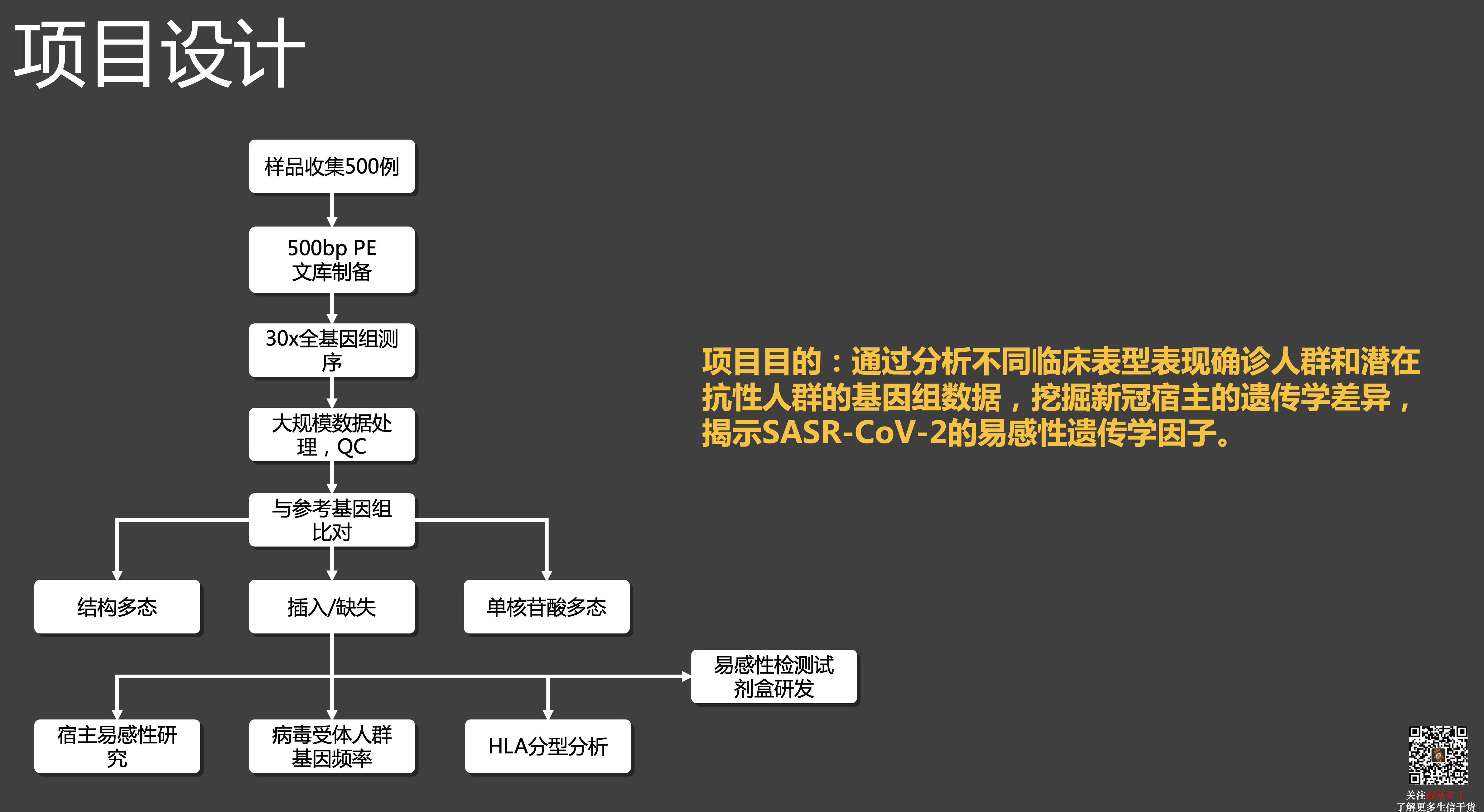



原文链接: 10.1038/s41421-020-00231-4
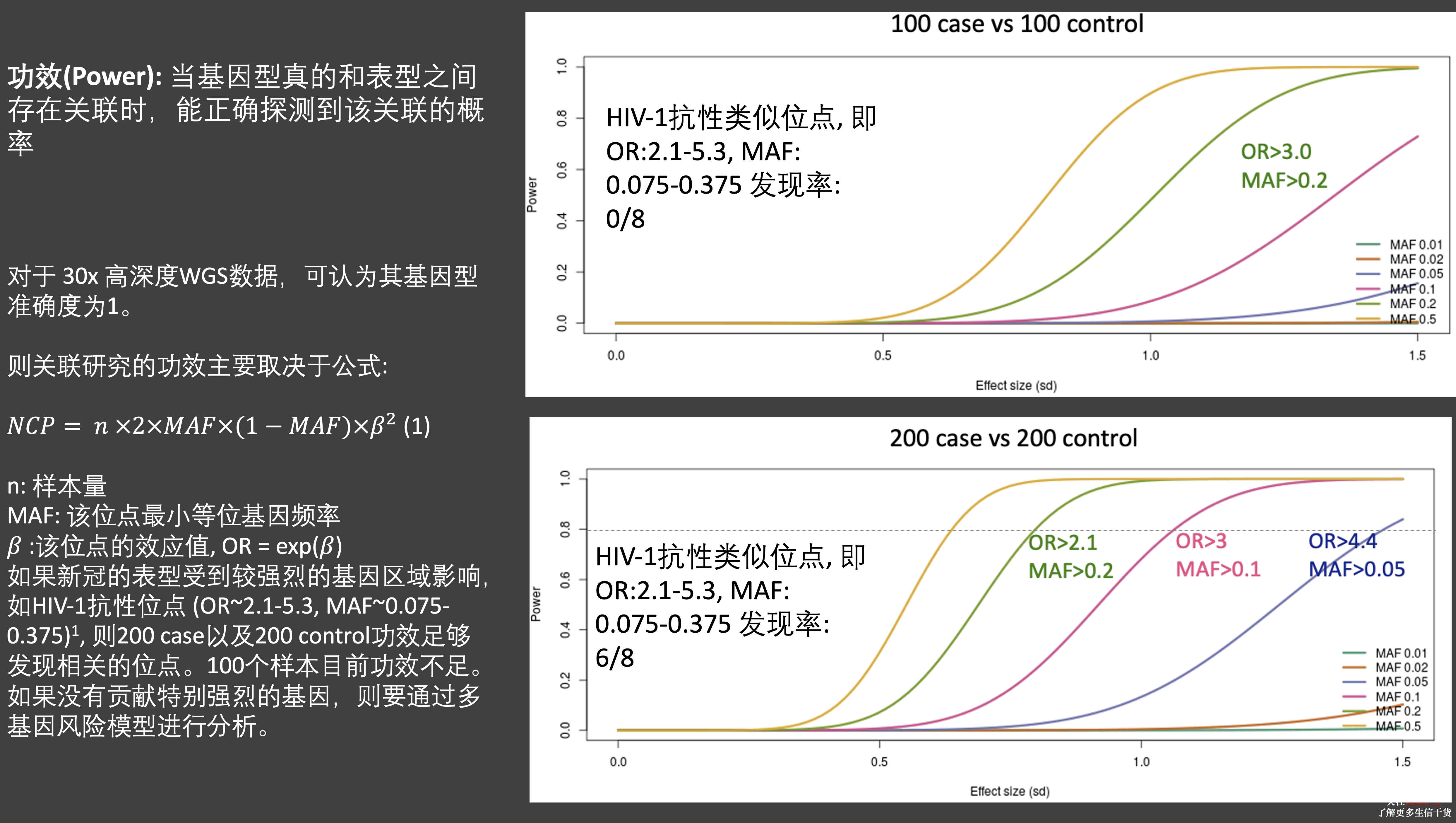
需要指出的是,当时由于 COVID-19 初发,我们可能也是第一个开展该项研究的团队,但也因此所能获得的样本并不多,结论方面和我们的预期是有些落差的。
科学研究具有不确定性,科学发现的道路是曲折的,付出了也不一定有回报。
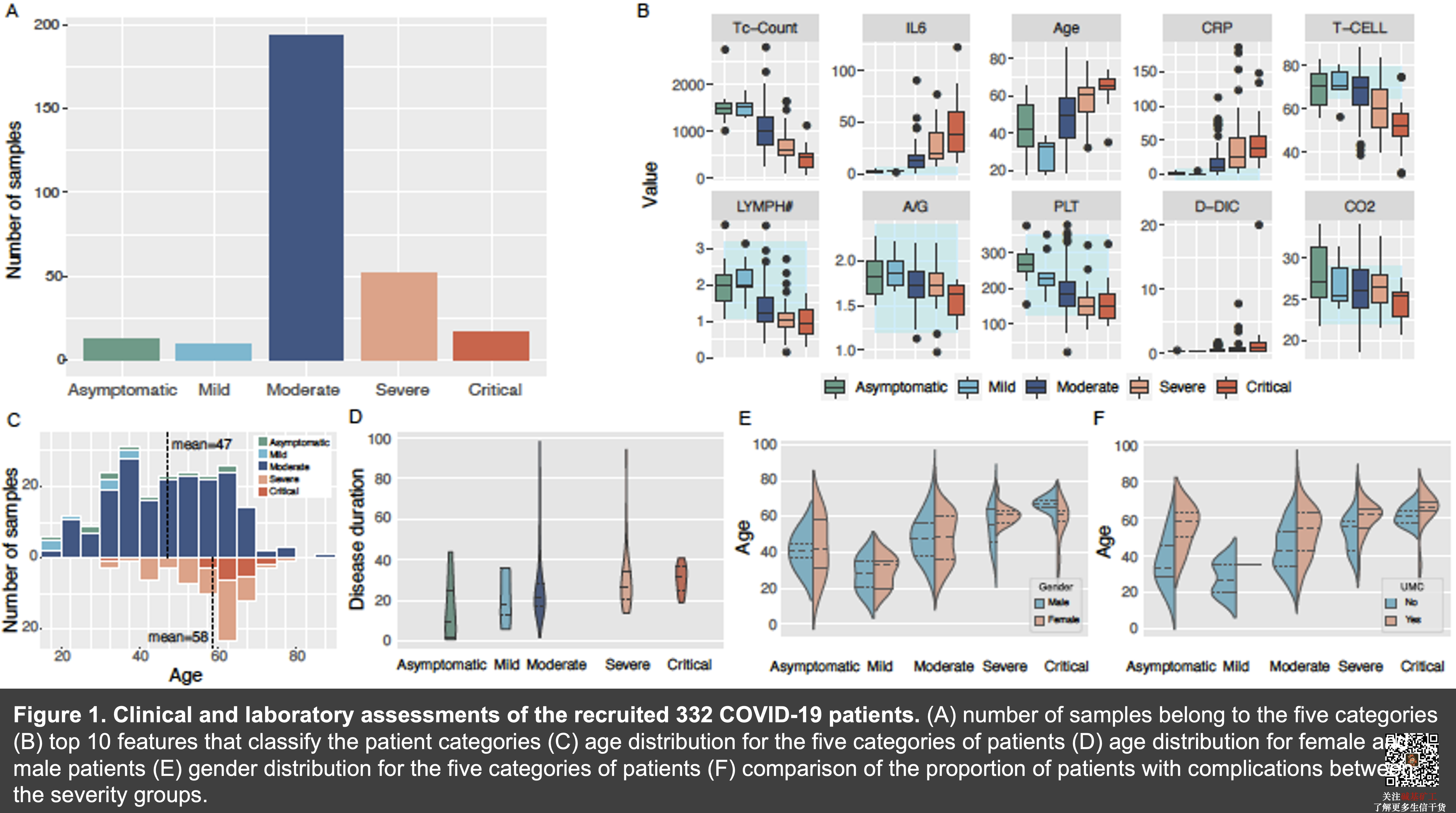
在医院的332名患者中,新冠感染患者存在着较大的表型差异。大约67.82%患者为普通型,而有11.1%为轻症或无症状,20.08%会发展成为重症。
在64中临床检测数据以及年龄、性别人口统计性数据中,与五种类别的疾病严重程度最为相关的临床特征分别为杀伤性T细胞的数目、白细胞介素-6、年龄、超反应蛋白、T细胞总数、淋巴细胞总数、白/球比值、血小板计数、D-二聚体与二氧化碳,这一点与新冠入侵后宿主免疫反应一致。
重症病人年龄与其他的病人相比,平均大11岁。但是重症病人与其他病人性别以及并发症的比例不存在显著相关性。
332位患者中,其中48位为16个家系成员,284名无关人群。
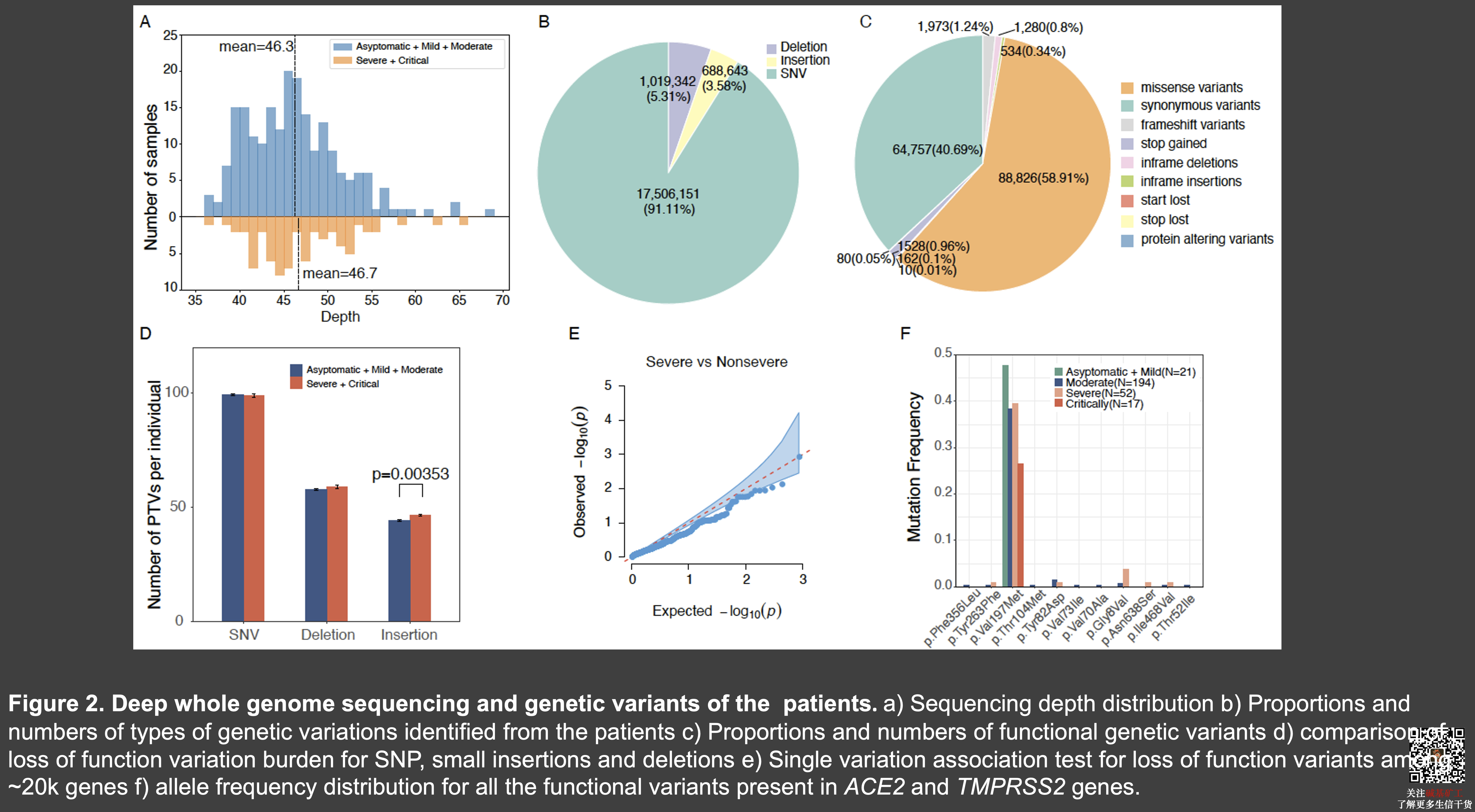
我们对332个病人进行了平均约46x的高深度测序,在重症病人与非重症病人中测序深度没有显著的差别。一共找到了22M的变异,包括了17.5M的二态单碱基突变以及1.71M的二态插入缺失等。还有2.4M其他的变异。我们注意到 SNP 和 deletion 的数目在两组人中没有明显的差别,但发现insertion在重症病人中有显著的增多,这其中的生物意义未明。在比较了重症与其他人群以及轻症是否在某些基因中存在差别之后,我们发现 RASA2 以及 MST1R 两个基因仅在轻症人群携带。但我们并没有发现 ACE2 与 TMPRSS2 功能突变变在这些不同类型病人中存在显著频率差异。
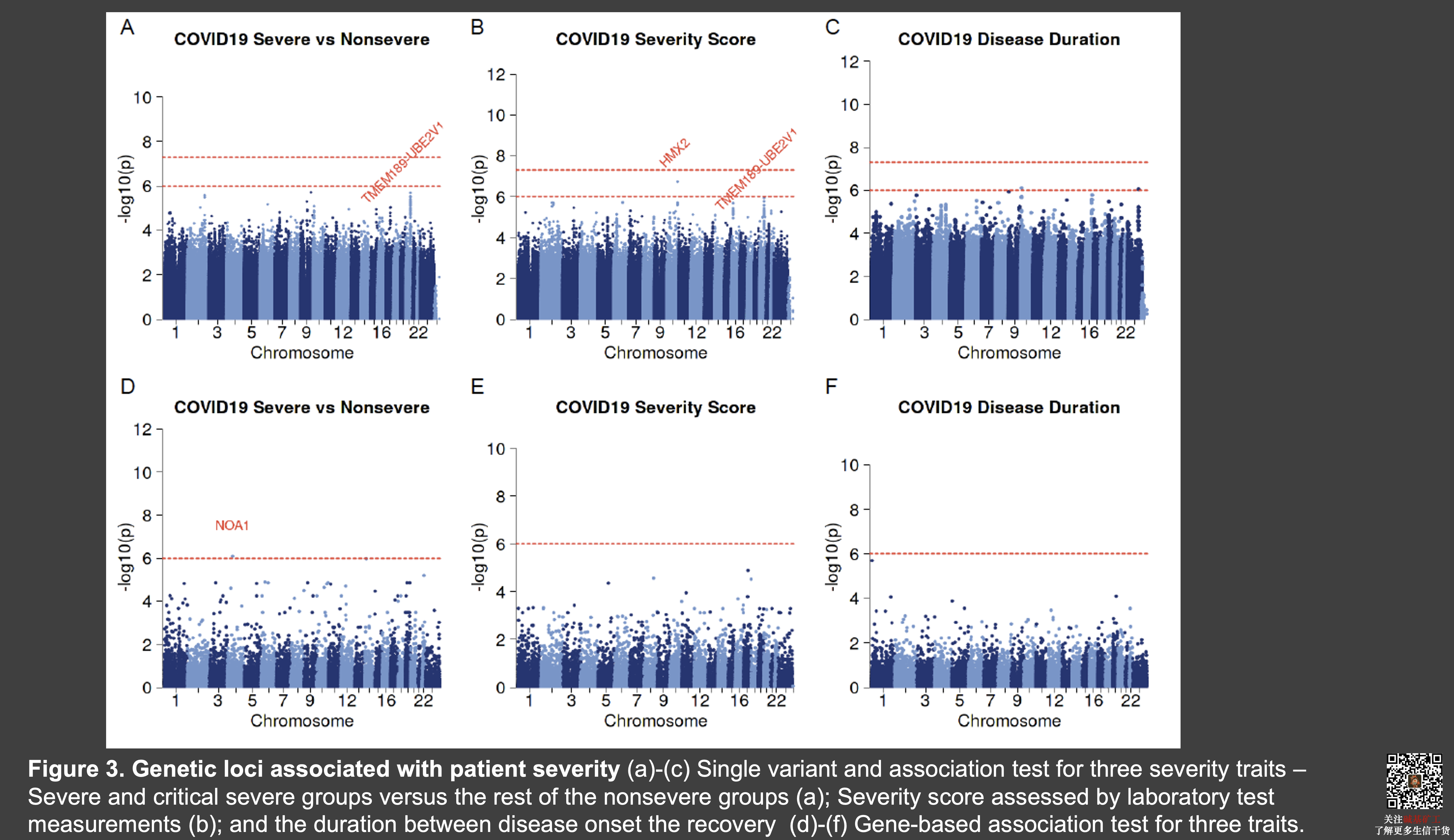
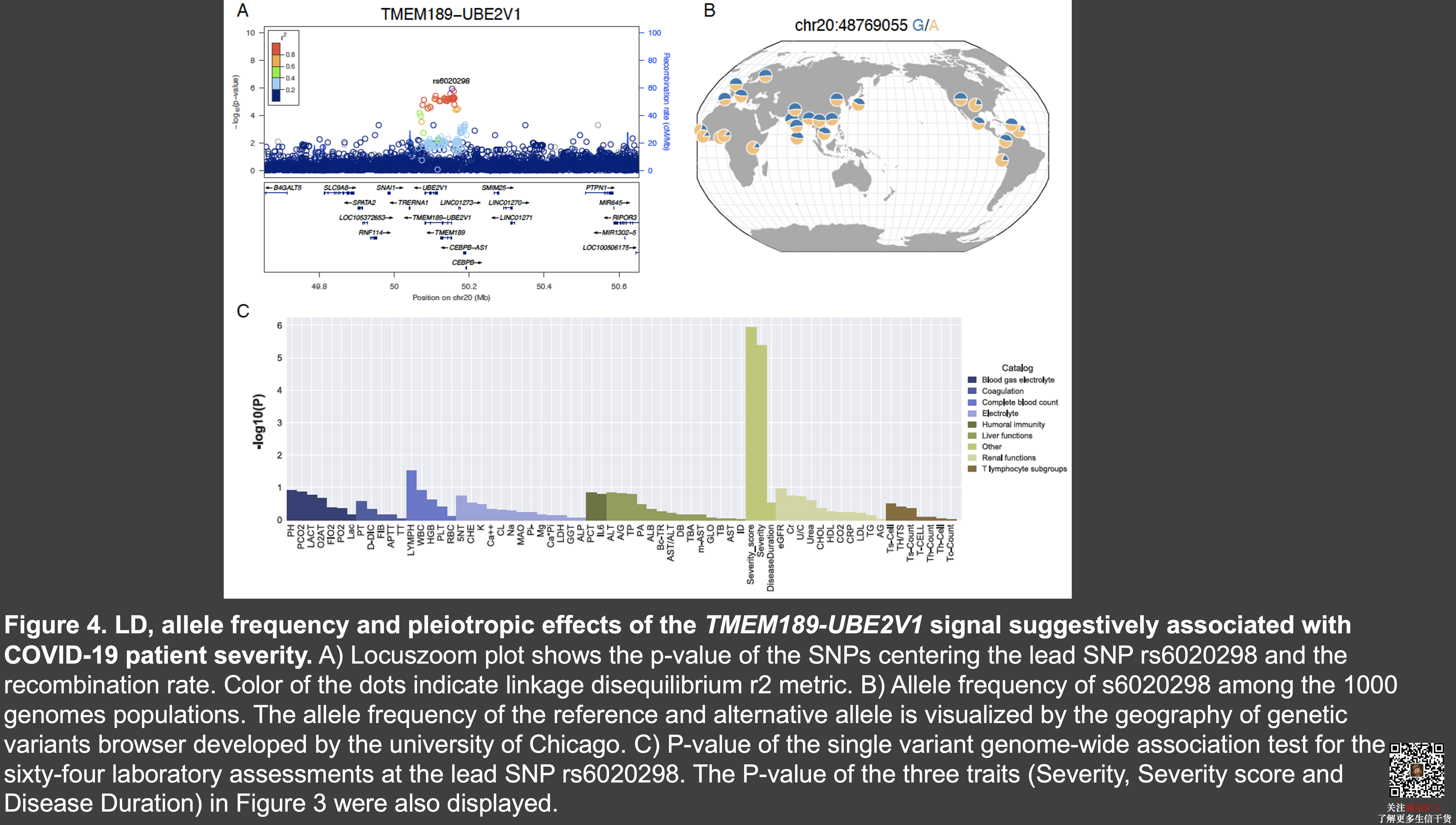
在对年龄、性别以及群体结构进行校正后,我们比较了重症患者与其他患者以及通过实验室指标计算出来的患者严重分数以及患者的患病时间这三个表型之间可能的遗传相关基因。我们发现了一个在白细胞介素1信号通路中的 TMEM189-UBE 的基因与疾病的严重程度存在可能的相关(p=4.4e-6)和 NOA1 这一个编码了线粒体 GTPase 酶。同样的,我们没有发现在 ACE2 或者 TRMPSS2 基因上任何位点的显著相关性。
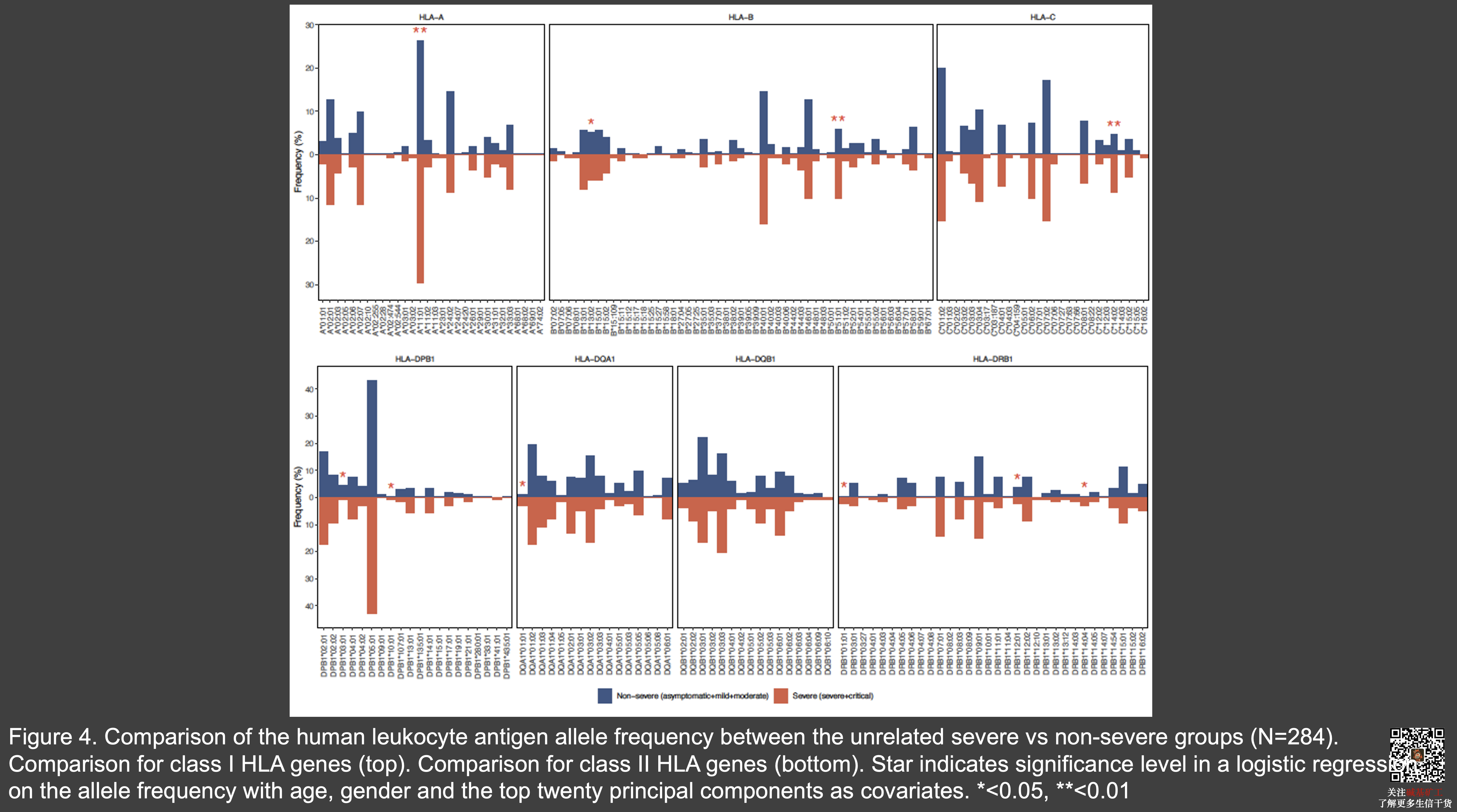
虽然 HLA 被怀疑与新冠病人表型多态性有关,我们并未发现重症病人与非重症病人之间在 HLA 单倍型频率存在显著差异。最相关的单倍型都位于HLA一型基因中 – HLA A* 11:01, B*51:01, C*14:02。这三个型别都是保护型。
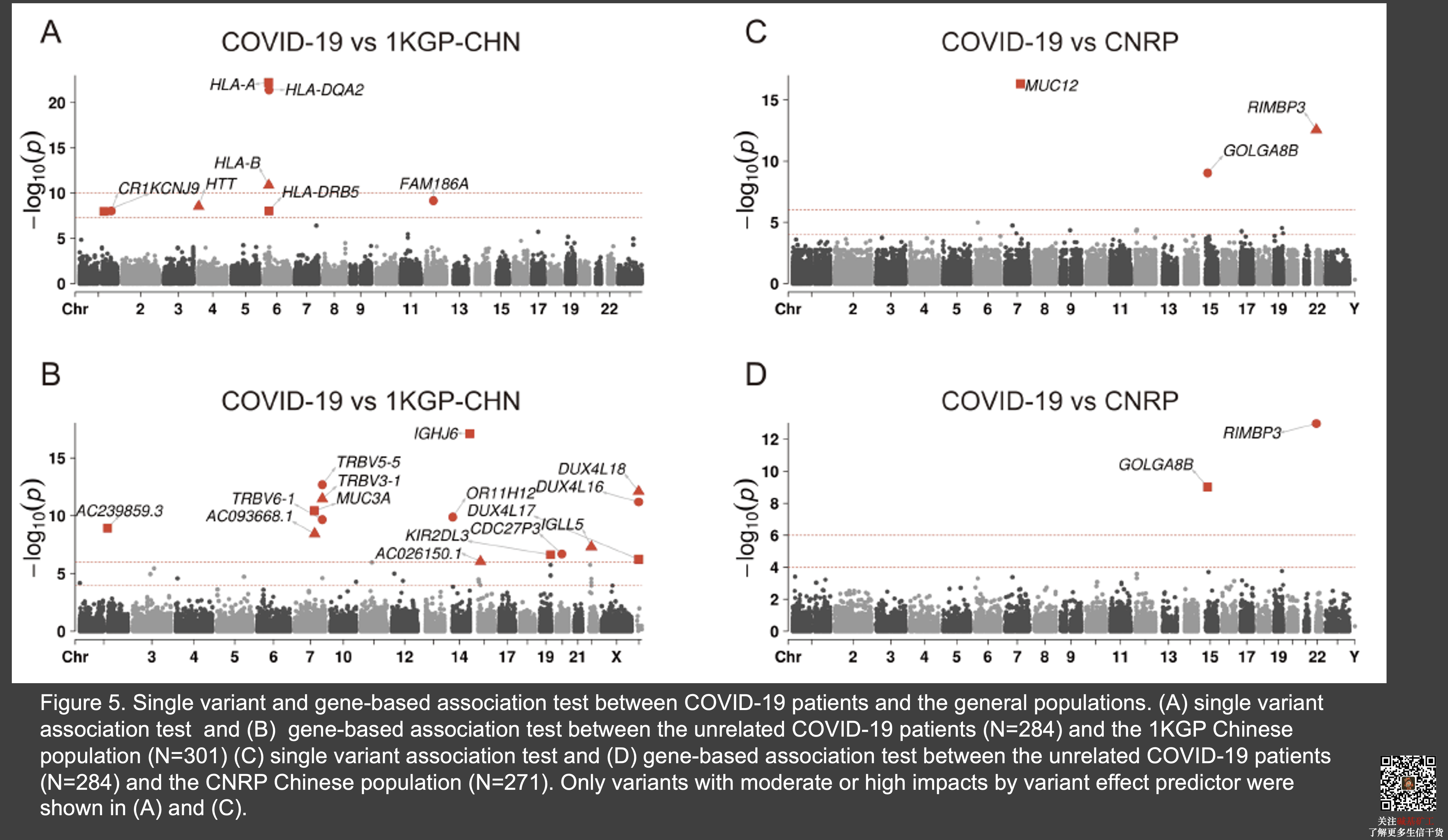
虽然新冠病毒被认为是普遍易感的,但我们还是尝试比较了新冠病人与自然人群之间是否存在一些显著的基因型差别。通过设置了两组自然人群:一组是千人301个中国人作为对照和一组是655个内部中国人基因组作为对照。在严格控制群体结构、年龄以及性别之后,我们发现在单点的检测中,新冠患者与千人基因组之间在 HLA 区域存在大量显著差异位点。在 gene-based 分析中,则发现了大量的免疫球蛋白区域存在着显著的关联信号。但是遗憾的是这些信号没有在新冠患者与另外一组自然人群的比较中重复出来。这暗示了千人与现有的一些数据之间或许是因为所用的样本不同(血液-含有能发生较多重组的B细胞与细胞系),测序片段长度、测序深度以及测序技术之间的batch effect导致了没法重复,而这在其他后续研究中应特别关注。

参考资料
- 王立铭《病毒科学 9 讲》
- Initial whole-genome sequencing and analysis of the host genetic contribution to COVID-19 severity and susceptibility.
订阅
文章首发于我的个人公众号:helixminer(碱基矿工)

